Essa rara mutação genética mata células cerebrais — e finalmente sabemos por quê.
Os resultados levantam a possibilidade de que vias semelhantes de morte celular também contribuam para outras doenças neurológicas, como Alzheimer, Parkinson ou Huntington.
Uma equipe liderada por pesquisadores do centro alemão Helmholtz Munich descobriu que mutações em um único gene fazem com que neurônios de camundongos sofram inflamação progressiva e morte celular. Em células cerebrais humanas cultivadas em laboratório, derivadas da pele de pacientes com a mesma mutação, os neurônios morreram de maneira surpreendentemente semelhante. Essa forma específica de morte celular programada é chamada de ferroptose, desencadeada pelo acúmulo de ferro e por danos oxidativos à membrana celular.
Segundo os pesquisadores, o mecanismo lembra processos de morte celular observados na demência, com base na análise das proteínas expressas pelos neurônios. Evidências recentes, por exemplo, indicam que a ferroptose está associada à doença de Alzheimer.
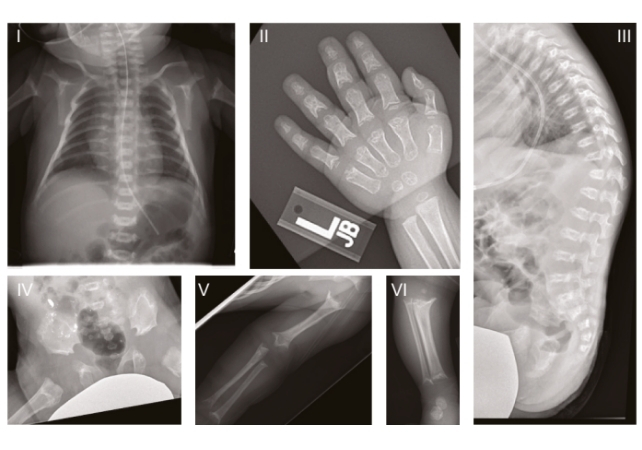
Em humanos, esse distúrbio genético ultra-raro é conhecido como displasia espondilometafisária do tipo Sedaghatian (SSMD), caracterizada por graves anomalias cerebrais e esqueléticas. A condição foi descrita pela primeira vez em 1980 e, desde então, apenas algumas dezenas de casos foram oficialmente registrados, muitos envolvendo crianças que morreram ainda nos primeiros meses de vida.
Cell , 2025)
Nos últimos anos, o sequenciamento genômico associou a SSMD a mutações no gene que codifica a enzima GPX4, frequentemente considerada uma “guardião” da ferroptose por proteger as membranas celulares contra danos oxidativos.
Embora mutações nesse gene não levem necessariamente à demência de início precoce, esta nova pesquisa, realizada em células de camundongos e em “minicérebros” cultivados em laboratório, revela como a GPX4 pode proteger os neurônios e como sua disfunção pode resultar em morte celular.
O estudo analisou três crianças com SSMD nos Estados Unidos, que apresentavam diferentes graus de atrofia cerebral e mutações na mesma região funcional do gene GPX4. Esses dados foram então utilizados em experimentos adicionais com camundongos e com células cerebrais cultivadas a partir da pele de um paciente com SSMD.
Marcus Conrad, biólogo celular e diretor do Instituto de Metabolismo e Morte Celular do Helmholtz Munich, compara a enzima GPX4 a uma prancha de surfe.
“Com sua quilha mergulhada na membrana celular, ela desliza ao longo da superfície interna e neutraliza rapidamente os peróxidos lipídicos à medida que avança”, explica.
No entanto, quando essa mutação específica da GPX4 está presente, a “quilha” da prancha está ausente. Isso significa que a enzima não consegue se ancorar à membrana e, portanto, não pode proteger o neurônio. Neurônios cultivados a partir de células-tronco de pacientes com SSMD mostraram-se especialmente vulneráveis à ferroptose. O bloqueio desse processo, tanto em camundongos quanto em células cultivadas em laboratório, por meio de um composto químico, pareceu desacelerar a morte neural.
“Nossos dados indicam que a ferroptose pode ser uma força motriz por trás da morte dos neurônios — e não apenas um efeito colateral”, afirma Svenja Lorenz, bióloga celular do Helmholtz Munich.
“Até agora, a pesquisa sobre demência frequentemente se concentrou em depósitos de proteínas no cérebro, as chamadas placas de beta-amiloide. Agora estamos dando mais ênfase aos danos às membranas celulares, que podem iniciar esse processo degenerativo.”
A demência costuma ser considerada uma doença associada à velhice, mas, em alguns cenários trágicos, o declínio cognitivo ligado a problemas de memória pode começar muito mais cedo. A demência infantil é uma condição rara que leva à perda de memória e confusão mental, e estudos genômicos já a associaram a mais de 100 distúrbios genéticos raros presentes desde o nascimento.
Investigar casos tão trágicos oferece aos cientistas informações cruciais sobre como a neurodegeneração pode ocorrer e sobre o que pode ser feito para combatê-la.
“Levamos quase 14 anos para associar um pequeno elemento estrutural, até então não reconhecido, de uma única enzima a uma doença humana grave”, afirma Conrad.
“Projetos como este demonstram de forma clara por que precisamos de financiamento de longo prazo para a pesquisa básica e de equipes internacionais e multidisciplinares, se quisermos realmente compreender doenças complexas como a demência e outras condições neurodegenerativas.”
O estudo foi publicado na revista Cell.