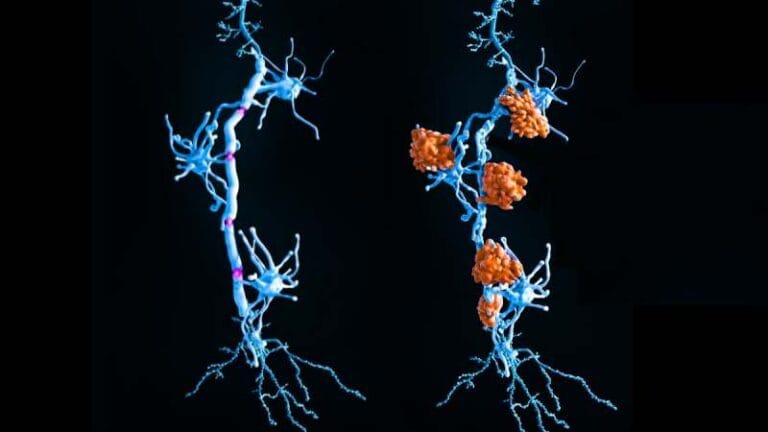
Nova ‘lupa molecular’ ilumina pontos críticos das proteínas para rastrear a doença de Alzheimer

Uma equipe da Rice University desenvolveu uma estratégia para ampliar pequenos segmentos de proteínas dentro de células vivas.
O método revela mudanças ambientais sutis que podem sinalizar os estágios iniciais de doenças como Alzheimer, Parkinson e câncer. As descobertas também apontam para novas formas de triagem de medicamentos que têm como alvo distúrbios de agregação de proteínas.
Os pesquisadores criaram uma sonda fluorescente, chamada AnapTh, em subdomínios precisos de proteínas. Essa sonda monitora mudanças em tempo real que as técnicas convencionais muitas vezes não detectam.
Ao rastrear mudanças localizadas, os cientistas podem observar como regiões distintas da mesma proteína se comportam de maneira diferente à medida que começam a se agregar.
“Essencialmente, construímos uma lupa molecular”, disse Han Xiao, professor de química e diretor do SynthX Center da Rice. “Isso nos permite visualizar mudanças ambientais sutis que antes passavam despercebidas.”
A equipe baseou seu projeto na ideia de que mudanças locais iniciais aparecem antes da aglomeração visível.
O AnapTh, um aminoácido fluorescente, altera seu espectro de emissão dependendo do microambiente circundante. Usando a expansão do código genético, os cientistas inseriram a sonda em locais escolhidos sem interromper o dobramento ou a função da proteína.
Essa abordagem proporcionou resolução espacial e monitoramento em tempo real que as ferramentas existentes não conseguiam oferecer.
“Queríamos um método para iluminar apenas um ponto em uma proteína e observar o que acontece ao seu redor em células vivas”, disse Mengxi Zhang, estudante de pós-graduação e coautor principal. “Quando a agregação começa, algumas partes se tornam mais densas e hidrofóbicas, enquanto outras permanecem inalteradas.”
A aplicação da técnica a proteínas relacionadas a doenças revelou um padrão surpreendente. A agregação não ocorreu de maneira uniforme.
Alguns subdomínios apresentaram maior intensidade de fluorescência e mudanças espectrais, indicando ambientes mais densos e quimicamente alterados. Outros permaneceram inalterados.

Esta descoberta desafia os modelos mais antigos que descreviam a agregação como uniforme.
Em vez disso, as evidências mostram que a agregação começa em “pontos críticos” discretos e depois se espalha. Esses eventos iniciais de desdobramento localizados podem se tornar biomarcadores futuros ou servir como pontos de entrada terapêuticos.
Os resultados reformulam a maneira como os cientistas veem a agregação de proteínas.
Eles destacam um processo que é desigual e dinâmico, com locais específicos impulsionando as primeiras alterações relacionadas à doença. Essa nova perspectiva fornece uma visão renovada sobre os gatilhos moleculares da neurodegeneração.
A agregação de proteínas está na base de doenças devastadoras, como as placas de Alzheimer, os corpos de Lewy de Parkinson e as proteínas mal dobradas no câncer.
Compreender onde e como essas mudanças começam dá aos pesquisadores um caminho mais claro para os tratamentos. A descoberta oferece uma lente mais nítida para estudar como pequenos erros na dobragem de uma espiral se transformam em grandes ameaças à saúde.
A equipe da Rice também demonstrou como a plataforma poderia ajudar na descoberta de medicamentos. Ao detectar alterações precoces no subdomínio, a ferramenta pode acompanhar a progressão da doença com mais sensibilidade.
Os pesquisadores também podem identificar compostos que intervêm antes que a agregação se espalhe.
“Esta plataforma nos dá um impulso inicial”, disse Shudan Yang, estudante de pós-graduação e coautor principal. “Agora podemos testar inibidores potenciais e ver, ao primeiro sinal de problema, se eles impedem o desdobramento local incorreto.”
Esse nível de precisão, acrescentou Yang, é exatamente o que o desenvolvimento de medicamentos precisa.
A abordagem pode encurtar os prazos para a triagem de medicamentos e aprimorar o direcionamento de pontos fracos específicos da doença.
Os coautores do estudo incluem os pesquisadores da Rice Shikai Jin, Yuda Chen, Yiming Guo, Yu Hu e Peter Wolynes.
O estudo foi publicado na revista Nature Chemical Biology.