Proteínas do Leite Sem Vacas
Um estudo publicado na revista Trends in Biotechnology revela uma solução inovadora para a produção de proteínas lácteas sem a necessidade de vacas. Pesquisadores europeus conseguiram fabricar caseína funcional utilizando bactérias, uma alternativa que pode reduzir os impactos ambientais da pecuária e impulsionar o mercado de laticínios sustentáveis.
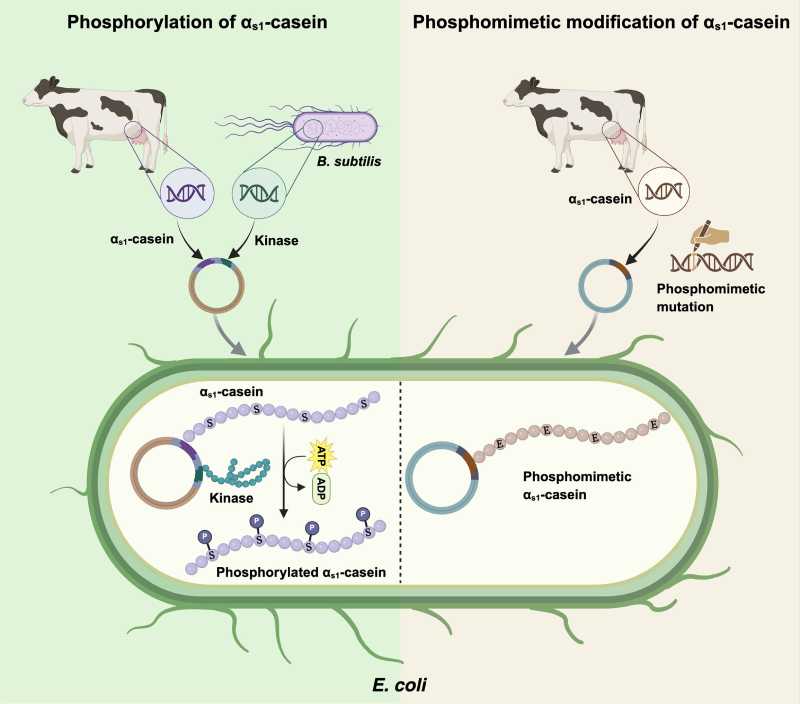
A caseína é a principal proteína do leite, essencial na fabricação de queijos, iogurtes e outros derivados. Ela é responsável por propriedades importantes, como textura, cremosidade e capacidade de transportar nutrientes, especialmente cálcio. O desafio para produzir essa proteína fora do sistema animal sempre foi replicar uma modificação química específica: a fosforilação.
A fosforilação é um processo natural que acontece no organismo dos mamíferos, onde grupos fosfato são adicionados à caseína. Esse detalhe é crucial para que a proteína consiga se ligar ao cálcio e formar micelas, pequenas estruturas responsáveis pela estabilidade e funcionalidade do leite.
Bactérias como Escherichia coli, amplamente usadas na biotecnologia, não realizam essa modificação sozinhas, o que limitava as tentativas anteriores de produzir caseína de forma funcional.
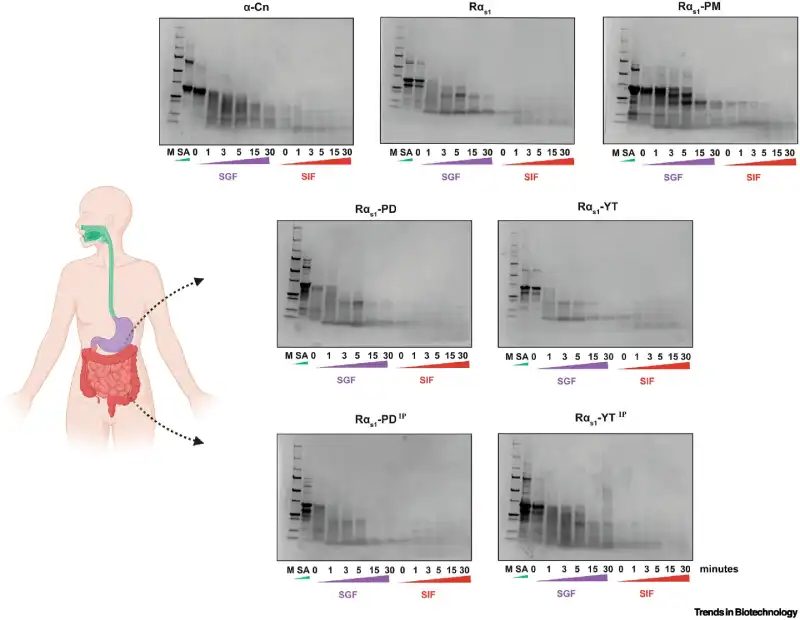
Os pesquisadores também testaram como as proteínas produzidas se comportam durante a digestão. Os resultados mostraram que, assim como as proteínas do leite convencional, as versões criadas em laboratório foram rapidamente digeridas em simulações do sistema gastrointestinal. Abaixo, é possível ver o comportamento das proteínas ao longo do processo de digestão:
Para resolver a questão, a equipe de pesquisadores apostou em duas estratégias diferentes. A primeira foi modificar geneticamente a bactéria E. coli para produzir enzimas chamadas quinases, originárias de outra bactéria, a Bacillus subtilis. Essas enzimas conseguem fosforilar a caseína durante sua produção dentro da bactéria.
A segunda solução dispensou as enzimas: os cientistas alteraram diretamente a estrutura da caseína, substituindo alguns aminoácidos por outros que imitam a carga elétrica da fosforilação, técnica conhecida como fosfomimética.
Os testes mostraram que as duas abordagens funcionaram bem. As versões fosforilada e fosfomimética da caseína se ligaram ao cálcio de maneira eficiente e mantiveram propriedades similares às proteínas do leite bovino. Isso significa que elas podem ser utilizadas na indústria para fabricar produtos com sabor e textura semelhantes aos tradicionais.
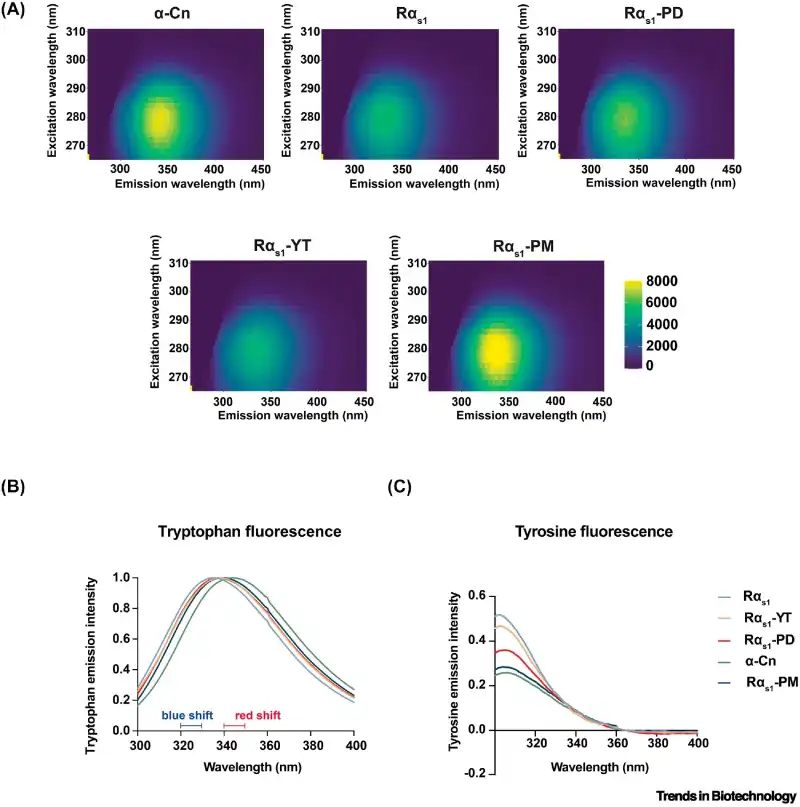
Além da capacidade de ligação ao cálcio, o estudo também analisou as características estruturais da caseína produzida. Utilizando métodos de fluorescência, foi possível observar que a estrutura das proteínas recombinantes se assemelha à da caseína bovina, mantendo a integridade funcional necessária para aplicações alimentícias.
A pecuária é frequentemente apontada como uma das principais fontes de emissões de gases de efeito estufa e consumo excessivo de água. A produção microbiana de proteínas lácteas surge como alternativa para reduzir esses impactos ambientais, além de criar novas opções para quem tem intolerância à lactose ou alergias ao leite convencional.
Embora o método ainda esteja em fase laboratorial, o estudo indica um futuro em que queijos e iogurtes possam ser produzidos sem vacas e com menor impacto ambiental — sem abrir mão da qualidade nutricional dos produtos lácteos.